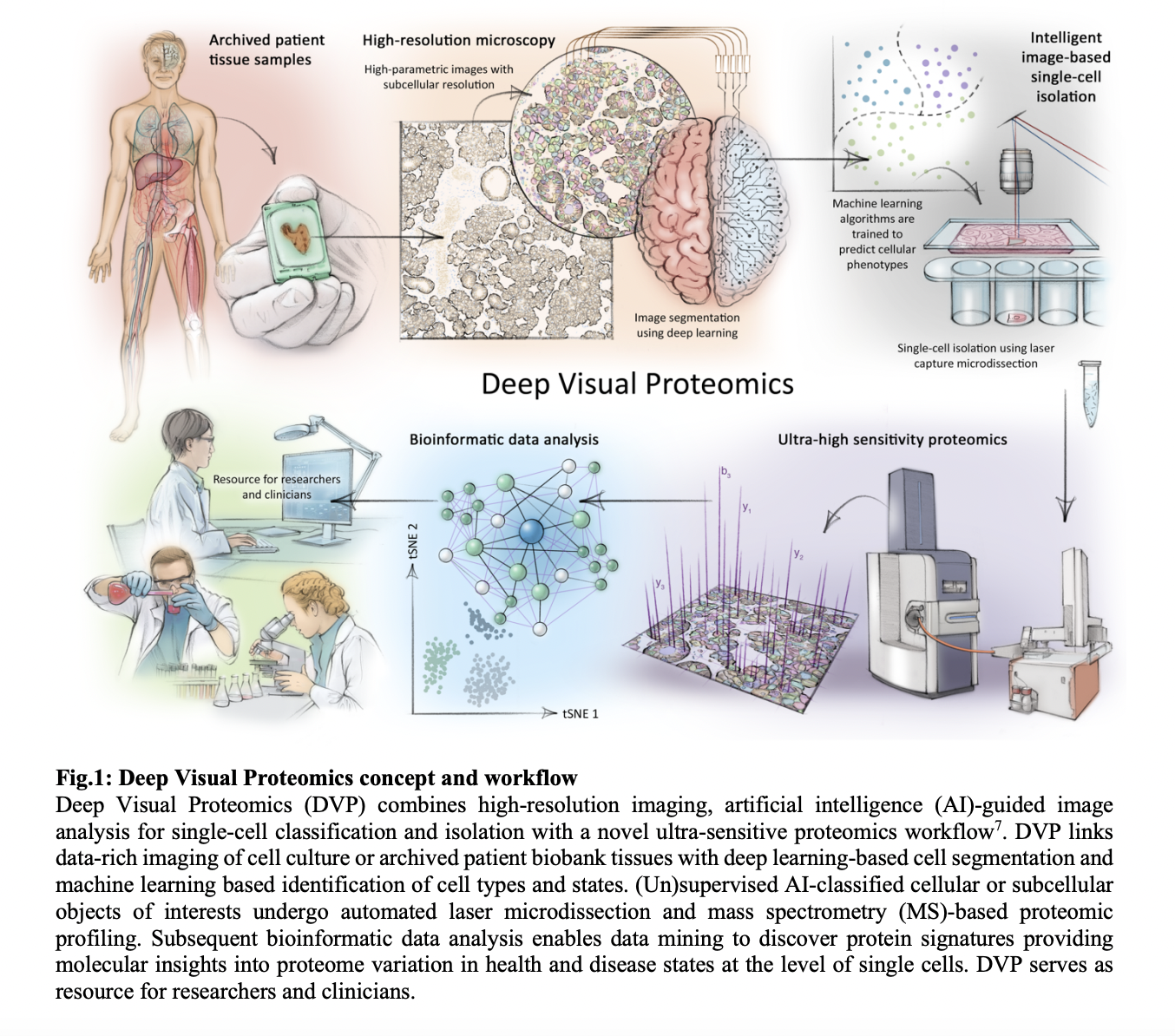
«`html
Глубокая визуальная протеомика: интеграция ИИ и масс-спектрометрии для фенотипирования клеток
Практические решения и ценность
Глубокая визуальная протеомика (DVP) революционизирует анализ клеточных фенотипов путем объединения передовой микроскопии, ИИ и ультрачувствительной масс-спектрометрии (MS). Традиционные методы часто ограничиваются небольшим подмножеством белков, но DVP расширяет эту возможность, позволяя проводить всесторонний протеомный анализ в естественном пространственном контексте клеток. Этот подход включает высокоразрешающую микроскопию для фенотипирования одиночных клеток, AI-управляемую сегментацию клеток и автоматизированную лазерную микродиссекцию для точной изоляции клеточных или субклеточных областей интереса. Полученные образцы подвергаются ультравысокочувствительной масс-спектрометрии для детального протеомного профилирования.
Разработанный с использованием программного обеспечения для биологического анализа изображений (BIAS), DVP обеспечивает беспрепятственную интеграцию технологий изображений и протеомики. Он позволяет идентифицировать отдельные типы клеток и состояния на основе определенных ИИ-определенных признаков, повышая точность и эффективность клеточного фенотипирования. Применения DVP охватывают изучение гетерогенности одиночных клеток и характеристику протеомных различий в тканях заболеваний, таких как меланома и рак слюнных желез. Сохраняя пространственную информацию наряду с молекулярными данными, DVP предлагает мощный инструмент для продвижения исследований и клинической диагностики в биологии клеток и заболеваниях.
Обработка изображений и рабочий процесс изоляции одиночных клеток в глубокой визуальной протеомике
Рабочий процесс обработки изображений и изоляции одиночных клеток в DVP интегрирует передовые технологии микроскопии с передовым AI-управляемым анализом изображений и автоматизированной лазерной микродиссекцией. Начиная с микроскопии высокого разрешения, процесс включает захват изображений всего слайда, которые обрабатываются с использованием BIAS. BIAS поддерживает различные форматы микроскопии и использует алгоритмы глубокого обучения для точной сегментации клеточных компонентов, таких как ядра и цитоплазма. Это включает инновационные техники, такие как передача стиля изображения, чтобы оптимизировать обучение модели глубокого обучения для конкретных биологических контекстов. BIAS обеспечивает беспрепятственное взаимодействие с системами лазерной микродиссекции, такими как ZEISS PALM MicroBeam и Leica LMD6 & 7, обеспечивая точный трансфер и автоматизированное извлечение целенаправленных клеток. Этот интегрированный рабочий процесс обеспечивает быструю и точную изоляцию одиночных клеток, что критически важно для глубокого протеомного анализа клеточных и тканевых образцов в приложениях DVP.
Характеризация гетерогенности одиночных клеток с помощью глубокой визуальной протеомики
DVP позволяет характеризовать функциональные различия среди фенотипически различных клеток на субклеточном уровне. Применяя этот рабочий процесс к неповрежденной линии раковых клеток, исследователи использовали сегментацию на основе глубокого обучения для изоляции и анализа отдельных клеток и ядер. Этот подход решил проблемы обработки малых образцов, позволяя прямой анализ из 384 ямок с использованием передовой масс-спектрометрии. Протеомные профили целых клеток и изолированных ядер отличались с высокой воспроизводимостью. Машинное обучение выявило шесть классов ядер с значительными морфологическими и протеомными различиями. Это показало, что видимые клеточные фенотипы соответствуют отдельным протеомным профилям, предлагая представления о регуляции клеточного цикла и потенциальных прогностических маркерах рака.
Глубокая визуальная протеомика раскрывает гетерогенность опухолевой ткани рака
DVP предлагает высокоразрешенное, непредвзятое протеомное профилирование отдельных классов клеток в их пространственной среде. Примененный к архивированным образцам рака ацинусовой клетки слюнной железы, DVP выявил значительные протеомные различия между нормальными и раковыми клетками. Нормальные ацинусовые клетки показали высокое выражение секретируемых белков, в то время как раковые клетки проявляли повышенное выражение белков ответа на интерфероны и протоонкогена SRC. Расширяя это на меланому, DVP разделил центральные клетки опухоли от тех, находящихся на границе опухоль-строма, выявив отличные протеомные сигнатуры, связанные с прогрессией заболевания и прогнозом. Эти результаты подчеркивают потенциал DVP для точной молекулярной типизации заболеваний, направляя клиническое принятие решений.
Перспективы для DVP
Пайплайн DVP интегрирует микроскопию высокого разрешения с передовым распознаванием изображений, автоматизированной лазерной микродиссекцией и ультрачувствительной масс-спектрометрией. Эта мощная система применима к разнообразным биологическим системам, которые могут быть подвергнуты микроскопическому изображению, от клеточных культур до патологических образцов. DVP позволяет быстро сканировать слайды для изоляции редких клеточных состояний и изучения протеомного состава внеклеточной матрицы. С потенциалом для суперразрешающей микроскопии DVP может достичь точной классификации состояний клеток. Объединяя мощные технологии изображений с непредвзятой протеомикой, DVP предлагает значительные применения в основной биологии и биомедицине, особенно в онкологии, где он улучшает цифровую патологию, предоставляя всесторонний протеомный контекст.
Проверьте статью. Вся заслуга за это исследование принадлежит исследователям этого проекта. Также не забудьте подписаться на нас в Twitter.
Присоединяйтесь к нашему Telegram-каналу и группе LinkedIn.
Если вам нравится наша работа, вам понравится наша рассылка.
Не забудьте присоединиться к нашему сообществу 46k+ ML на Reddit.
Опубликовано на MarkTechPost.
